Hallo meine Lieben,
der Liebe @yngfinn hat mich gefragt wie ich Aktien finde. An der Antwort möchte ich euch gerne Teil haben lassen.
@yngfinn
Hallo mein Lieber,
da ich gerade genug Positionen im Depot habe, schaue ich nicht mehr so intensiv nach neuen Unternehmen. Traden tue ich nicht, und bin eher langfristig orientiert.
Meine Vorgehensweise ist ganz unterschiedlich.
Nach Sektoren:
Ich schaue oft in welchen Sektoren und Bereichen gerade Bewegung ist. Oder was Zukunftsbereiche sind wie Robotik, Defense und Aerospace, KI usw.
Aber auch danach welche Sektoren und Länder in meinem Depot unterbewertet sind.
Oder auch in welchen Sektoren ich Nachholbedarf sehe, weil sie ungerechtfertigt nach unten getrieben wurden. Wie es in etwa 🍊 im Gesundheitswesen gemacht hat.
Schaue mir Reportagen und Dokus an. Wie in etwa Erforschung der Ozeane und Meere. Und entdecke dadurch Kraken Robotic $PNG (-6,44 %) und Norbit $NORBT (+0,71 %) .
https://getqu.in/Ey45a0/
Nach Powels Rede von Freitag wäre es jetzt z.b. sinnvoll nach Immobilien und Hausbauern zu suchen. Wie in etwa Buffet seiner Aktie Dr. Horten $DHI (-1,25 %) .
Die leider andauernden Kriege zeigen die Bedeutung von Drohnen und Drohnenabwehr auf.
Aber auch die zunehmende Bedeutung in der Landwirtschaft (Hierzu habe ich auch schonmal einen Post gemacht).
https://getqu.in/SdXvMm/
Am Ende ist hier meine Wahl auf $AVAV (-2,23 %) AeroVironment gefallen. Und den Auftragsfertiger $KIT (+2,23 %) Kitron.
Im Zukunftssektor Robotik möchte ich eigentlich ungern auf überbewertete Aktien wie $TSLA (-6,86 %) Tesla oder den Auftragsfertiger $JBL (-5,69 %) Jabil zurück greifen. Hier sehe ich Japan als sehr innovativ. Wie es z.B $7012 (-7,11 %) Kawasaki zeigt. So habe ich den Schaufellieferanten $6481 (-1,59 %) THK entdeckt (hierzu gab es einen Post von mir).
https://getqu.in/fZudqX/
Nach Ländern:
Als der Iran, Israel angegriffen hat, habe ich den Dip genutzt, und mir Israelische Aktien vorgenommen.
So habe ich z.B. Gilat $GILT (-4,1 %) entdeckt.
Aber als langfristiger Anleger sehe ich die USA weiterhin vorne. Hier schaue ich mir gerne auch mal Small und Mid Caps an.
Oft schaue ich mir aber auch Länder an welche nicht ganz so im Fokus stehen. Skandinavien oder Italien.
Gefunden habe ich $LTMC (-3,94 %) Lottomatica und $CAMX (-1,75 %) Camurus.
Schaue mir in den Ländern oft auch nur die Unternehmen nach Momentum, aus den verschiedenen Indices an.
Nach Unternehmen:
Oft schaue ich auch welche Unternehmen gerade die Stars an der Börse sind. Wie z.B. Rheinmetall, dann gehe ich aber nicht in die Überbewertet Aktie, sondern suche mir Zulieferer, also Schaufellieferanten raus. So bin ich z.b. auf Kitron $KIT (+2,23 %) gestoßen. Kitron als Auftragsfertiger für den Verteidigungsbereich.
Oder als Novo Nordisk noch ein Star war, habe ich den Novo Zulieferer $YPSN (-1,56 %) entdeckt.
Nvidia Zulieferer $HY9H (-4,16 %) sk Hynix.
Wohin geht das Capex der Unternehmen?
Aufgrund dieser Frage bin ich auf die KI Infrastruktur Unternehmen $IESC (-8,92 %) IES Holding und $VRT (-6,22 %) Vertiv gestoßen.
Die schwäche eines Unternehmen macht andere Unternehmen stark.
Die schwäche von Boeing macht $AIR (-2,1 %) und $ERJ (-3,01 %) stark. So bin ich auf Embraer und $MTX (-2,98 %) MTU gekommen.
https://getqu.in/4hiSbt/
Recherche und Berichte, wie in etwa über coinbase $COIN (-9,55 %) (VORSICHT nie aufgrund einer Story kaufen).
https://getqu.in/OIiwhP/
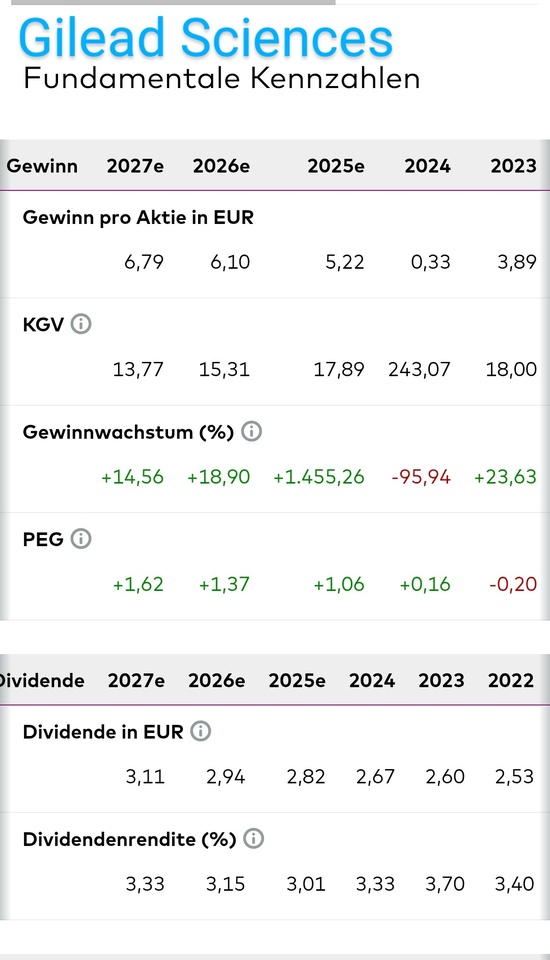
Gute Unternehmenszahlen mit Wachstumsstory könnten auch ein Grund sein. Wie in etwa bei $GILD (-0,04 %) Gilead.
https://getqu.in/iF8BDY/
Übernahmephantasien:
Bei Übernahme Gerüchten ist es meistens so, dass die Aktie des zu übernehmenden Unternehmen steigt.
Wie es in etwa bei $AWE (-2,82 %) Alphawave der Fall war.
https://getqu.in/1NPNWI/
Oder bei Iveco $IVG (-0,43 %)
https://getqu.in/WJnLFp/
https://getqu.in/VnK4Xk/
VORSICHT: Hier kann auch immer etwas schief gehen und die Aktie in den Keller schicken.
So habe ich es selber bei i robot erlebt, als Großbritannien einer Übernahme durch Amazon nicht zugestimmt hat.
Egal in welchen der Bereiche. Ist meine Vorgehensweise meist, mir hier die Momentum Aktien herauszusuchen. Gucke mir dann hier die Multiples, Nachrichten, Auftragslage und natürlich das Unternehmen an.
Compounder und Dauerläufer:
Bei meinem Core setze ich ausschließlich nur auf Qualitätsaktien mit Burggraben.
Hier macht es Sinn nicht am ATH zu kaufen, sondern im Dip.
Multiples:
Wichtig ist mir bei den Multiples:
-profitables Unternehmen, oder im nächsten Jahr
Profitable.
-am liebsten zweistelliger Gewinnwachstum bei sinkenden KGV.
-Prozentualer Gewinnwachstum ist höher als Umsatzwachstum.
-gute und steigende EbiT Marge.
-PEG unter oder um die 1
-steigender Free Cashflow unter Berücksichtigung des Capex.
Meine Lieben,
Ich hoffe meine kleine Zusammenfassung meiner Vorgehensweise bietet euch vielleicht einen kleinen Mehrwert.
Lasst es mich gerne in den Kommentaren wissen.
Gerne auch Verbesserungsvorschläge. 😘😘